目前,支原体核酸检测法(常规PCR、荧光定量PCR)应用较为广泛,尤其在生物制药和细胞治疗领域,可以替代传统的培养法和DNA染色法。但同时,各种品牌的支原体PCR和qPCR检测试剂盒又良莠不齐,因此,对核酸法本身进行方法学验证是非常必要的。
上对支原体核酸法的验证提出了三项要求:检测限、特异性和耐用性。在检测限方面,欧洲药典除了规定要达到10CFU/ml或100CFU/ml外,也指出可以用等量的支原体核酸拷贝数来表示。这时就需要选用合适的支原体核酸标准品。
的微生物污染防控公司Minerva Biolabs(以下简称德国MB公司),专门提供包括欧洲/日本药典9种支原体在内的PCR定量标准品共14种,可进行10倍梯度稀释,制备标准曲线,确定核酸法的检测限,因而广受药厂的青睐。
德国MB公司提供的PCR定量标准品信息如下:
PCR定量标准品的物种 | 货号 |
口腔支原体 | 52-0112 |
鸡败血支原体 | 52-0115 |
莱氏无胆甾原体 | 52-0116 |
发酵支原体 | 52-0117 |
肺炎支原体 | 52-0119 |
关节液支原体 | 52-0124 |
精氨酸支原体 | 52-0129 |
猪鼻支原体 | 52-0130 |
柠檬螺原体 | 52-0164 |
唾液支原体 | 52-0103 |
百日咳杆菌 | 52-5571 |
大肠埃希菌 | 52-0083 |
嗜肺军团菌 | 52-0101 |
铜绿假单胞菌 | 52-0071 |
一、试剂盒组分:
试剂盒组分 | 数量 | 盖子颜色 |
PCR定量标准品1×108基因组拷贝/管 | 1管冻干粉 | 绿色 |
Tris缓冲液,10mM Tris,pH8.5(用于溶解和稀释标准品) | 2ml×3管 | 白色 |
说明:2-8℃保存。使用前,标准品溶解后在-18℃以下保存。避免反复冻融。
、质控保证
微生物在液体培养基中培养,并在对数生长期末期收集。DNA用酚氯fang抽提,继而用过滤柱纯化。DNA纯度用分光光度计法测量,保证OD260/280≥1.8。微生物物种用Sanger测序法确定。
纯化DNA的定量采用小牛胸腺DNA标准品进行光密度测量,进而用荧光法证实。DNA终稀释,并调整为1×108基因组拷贝/管。稀释倍数用qPCR分析证实。
三、操作步骤:
1、标准品复溶
(1)所有管短时离心。
(2)加入100μl Tris缓冲液到带绿盖的管中。
(3)室温静置5分钟。
(4)涡旋振荡10秒,再离心5秒。
(5)使用适当体积的DNA溶液直接用于PCR或直接稀释,用于制备DNA标准曲线
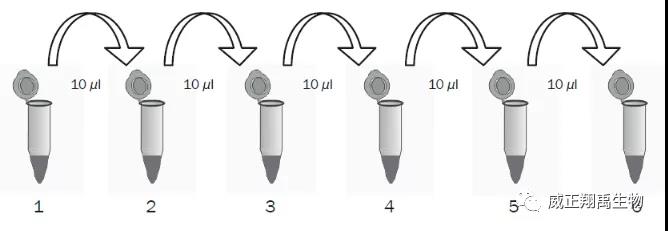
2、制备10倍稀释的DNA标准曲线
(1)使标准品和Tris缓冲液室温达到平衡。
(2)标记每个1.5ml离心管。每个管加入90ml Tris缓冲液。
(3)标准品混匀离心。
(4)标准品1:加10μl标准品母液到第1管,盖盖并混匀。简要离心。
(5)标准品2:从第1管中取出10μl到第2管,盖盖并混匀。简要离心。
(6)标准品3:从第2管中取出10μl到第3管,盖盖并混匀。简要离心。
(7)下面的管均重复以上步骤。推荐制备6个标准品(梯度稀释)。
对于qPCR,使用梯度稀释的DNA标准品,可制备标准曲线。大多数qPCR软件允许通过标准曲线进行定量分析。这依赖于正确的设置,包括标准曲线的参数。为便于正确定量,要确定你的标准曲线样品。使用者可以试用下列参数用于设置。体积决定了每个PCR反应的基因组拷贝数。
反应管编号 | 2μl样品 | 5μl样品 | 10μl样品 |
1 | 2×105基因组拷贝 | 5×105基因组拷贝 | 1×106基因组拷贝 |
2 | 2×104基因组拷贝 | 5×104基因组拷贝 | 1×105基因组拷贝 |
3 | 2×103基因组拷贝 | 5×103基因组拷贝 | 1×104基因组拷贝 |
4 | 200基因组拷贝 | 500基因组拷贝 | 1000基因组拷贝 |
5 | 20基因组拷贝 | 50基因组拷贝 | 100基因组拷贝 |
6 | 2基因组拷贝 | 5基因组拷贝 | 10基因组拷贝 |
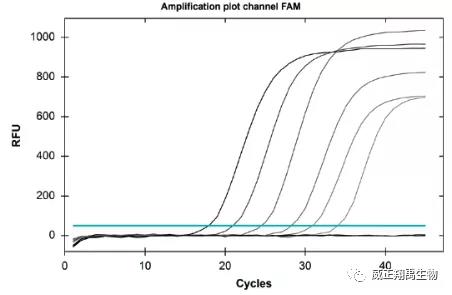
4、评估
使用梯度稀释,qPCR检测后Ct值会随着DNA浓度下降而升高。通过Ct值和DNA样本量产生一条标准曲线,未知样本的浓度通过标准曲线可以计算。下列的扩增曲线是用德国MB公司的Venor®
GeM qEP试剂盒绘制的。所用仪器为CFX96 Touch荧光定量PCR仪。
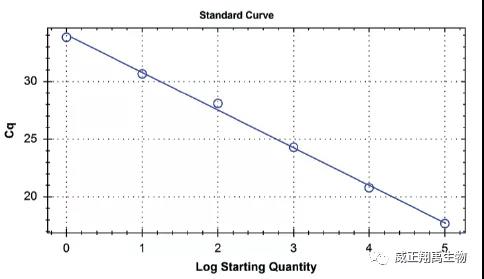
总之,PCR定量标准品可提供低拷贝数的DNA标准品,因而可精zhun确定核酸法的检测限。而10CFU的灵敏度标准品只能观察是否能达到这一阈值,而无法确定终为多少。从这个角度说,PCR定量标准品具有自己*的优势。